식약처, 국내·외 제조소서 만든 라니티딘 원료의약품 7종 조사
전체서 NDMA 잠정관리기준 초과 검출..병‧의원 등 처방 조치
“단기 복용한 경우 인체 위해우려 적어..장기 노출 영향은 조사”

[공공뉴스=정혜진 기자] 위장약 ‘잔탁’ 등 ‘라니티딘’ 성분을 사용한 의약품에서 발암 우려 물질이 초과 검출된 것으로 확인됐다.
이에 따라 보건당국은 라니티딘 성분 원료의약품을 사용한 국내 유통 완제의약품 269품목에 대해 잠정적으로 제조·수입 및 판매를 중지하고 처방을 제한하는 조치를 내렸다.
식품의약품안전처는 위궤양치료제나 역류성 식도염 치료제의 주원료로 사용되는 국내 유통 라니티딘 성분 원료의약품을 수거·검사한 결과, ‘N-니트로소디메틸아민’(NDMA)이 잠정관리기준을 초과해 검출됐다고 26일 밝혔다.
NDMA는 세계보건기구(WHO) 국제 암연구소(IARC)가 지정한 인체 발암 추정물질(2A)이다.
앞서 지난 14일 미국 식품의약청(FDA)은 라니티딘 성분 의약품에서 NDMA가 미량 검출됐다고 발표해 논란이 일었다. 이후 식약처는 국내로 수입되거나 국내에서 제조돼 유통 중인 라니티딘 성분 원료의약품을 수거해 검사를 실시했다.
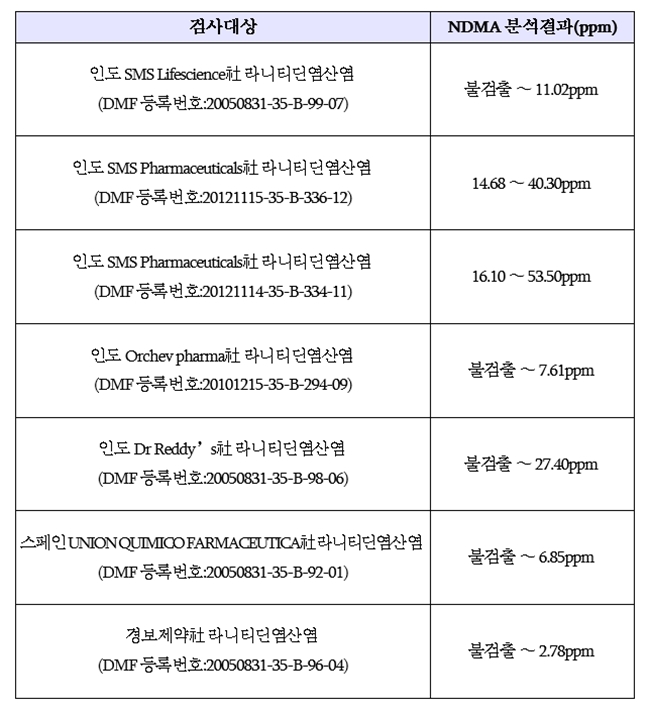
식약처가 국내·외 7개 제조소에서 만든 라니티딘 원료의약품(7종)을 검사한 결과, 모든 원료의약품에서 NDMA가 잠정관리기준(0.16ppm)을 초과해 검출됐다.
검사 대상이 된 원료제조소는 인도 5곳, 스페인 1곳, 국내는 경보제약 1곳이다. 제조단위별로 NDMA가 검출되지 않거나 최대 53.50ppm까지 검출되는 등 편차가 있었다.
식약처는 라니티딘의 NDMA 잠정관리기준 0.16ppm은 라니티딘 1일 최대 복용량(600mg)을 평생 섭취하는 것을 전제해 산정했다고 설명했다.
국제의약품규제조화위원회 가이드라인(ICH M7)과 국내·외 자료, 중앙약사심의위원회의 전문가 자문결과 등을 종합적으로 검토해 설정했다.
NDMA가 검출되는 원인에 대해 라니티딘에 포함돼 있는 ‘아질산염’과 ‘디메틸아민기’가 시간이 지남에 따라 자체적으로 분해‧결합해 생성되거나, 제조과정 중 아질산염이 비의도적으로 혼입돼 생성되는 것으로 식약처는 추정했다.
식약처는 관련 전문가들과 함께 ‘라니티딘 중 NDMA 발생원인 조사위원회’를 구성해 보다 정확한 원인을 분석할 계획이다.
이번 판매중지 대상은 허가된 라니티딘 성분 완제의약품 395개 품목 269개(133개사)다. 이 가운데 전문의약품은 174개 품목(113개사), 일반의약품은 95개 품목(74개사)이다. GSK ‘잔탁’, 대웅제약 ’알비스’ 등이 포함됐다.
지난해 기준으로 라니티딘 함유 의약품의 수입·생산 실적은 2664억원으로, 위장병(소화성궤양) 치료제 시장의 약 26.3%를 차지한다.
식약처는 전문가 자문을 거친 결과 라니티딘 성분 의약품을 단기 복용한 경우 인체 위해우려는 크지 않다고 밝혔다.
건강보험심사평가원의 보건의료 빅데이터에 따르면, 가장 많이 처방받은 질환은 위장질환(역류성식도염, 위염, 소화불량 등)이며 처방기간은 연간 6주 이하의 단기복용 환자의 비율이 높은 것으로 추정했다.
다만, 해당 의약품을 장기적으로 복용한 경우도 배제할 수 없어 식약처는 향후 라니티딘 성분 의약품에 장기간 노출되었을 때 인체에 미치는 영향을 조사·평가하기로 했다.
이를 위해 임상분야 등 관련 전문가들과 함께 ‘라니티딘 인체영향 평가위원회’를 구성, 조사를 실시하고 해외 규제기관과도 긴밀하게 협력할 방침이다.

한편, 보건복지부는 이날 오전 1시부터 병‧의원, 약국에서 해당 의약품이 처방‧조제되지 않도록 조치했다. 건강보험심사평가원 의약품안전사용정보시스템(DUR)을 통해 처방·조제를 차단하고, 건강보험 급여 적용도 정지했다.
해당 의약품 복용 중인 환자 수는 지난 25일 기준으로 총 144만명이다. 해당 의약품 처방 의료기관은 2만4301개소, 조제 약국은 1만9980개소로 집계됐다.
식약처는 “해당 의약품을 처방 받은 환자분들 중에서 안전에 우려가 있는 분들은 종전에 처방을 받은 병‧의원을 방문해 해당 의약품 포함여부 문의 및 위궤양치료제의 추가 복용 필요성 여부를 의료진과 상담하길 바란다”고 당부했다.
상담을 통해 위궤양치료제 등의 복용이 필요한 경우 문제의약품에 한해 병‧의원에서 재처방을 받으신 후 약국에서 재조제가 가능하다.
기존에 처방을 받은 병·의원 또는 약국에서 의약품의 재처방·재조제시 1회에 한해 환자 본인이 부담해야하는 본인부담금이 발생하지 않는다.
조치대상 의약품 중 의사의 처방 없이 약국에서 직접 구입이 가능한 일반의약품의 경우 약국을 방문해 교환 또는 환불 받을 수 있다.

